Le sperimentazioni cliniche con ATMP
Advanced Therapy Medicinal Products (ATMPs)
Le terapie avanzate comprendono terapie cellulari, terapie geniche e terapie di ingegneria dei tessuti e ATMP combinate che offrono soluzioni paziente-specifiche o per nicchie di pazienti e sono in grado di ristabilire funzioni fisiologiche compromesse, a volte con la correzione di mutazioni acquisite su base genetica. Per la prima volta non si tratta più di mitigare i sintomi di una condizione, ma di curarne le cause.
Le ATMP rientrano nella definizione tecnica di farmaco e, devono sottostare alle stesse procedure e ai regolamenti previsti dagli enti preposti. A livello europeo l’ente di riferimento è l’European Medicines Agency (EMA), mentre l’Agenzia Italiana del Farmaco (AIFA) si occupa delle procedure per l’autorizzazione di nuovi farmaci nel nostro Paese.
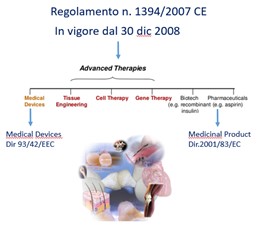
ATMP pongono numerose sfide, anche in ambito regolatorio e normativo.
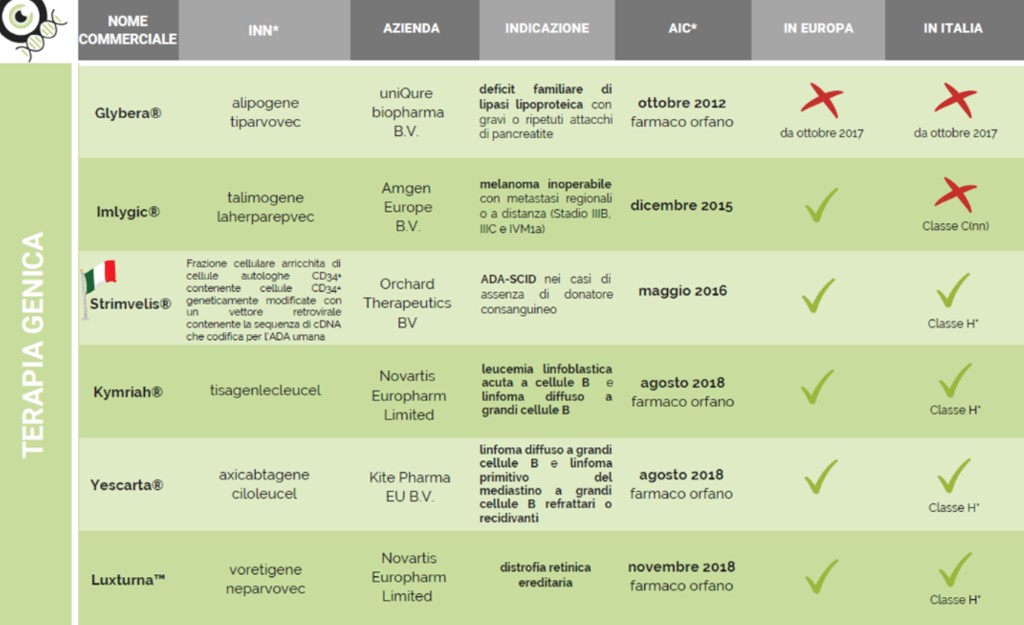
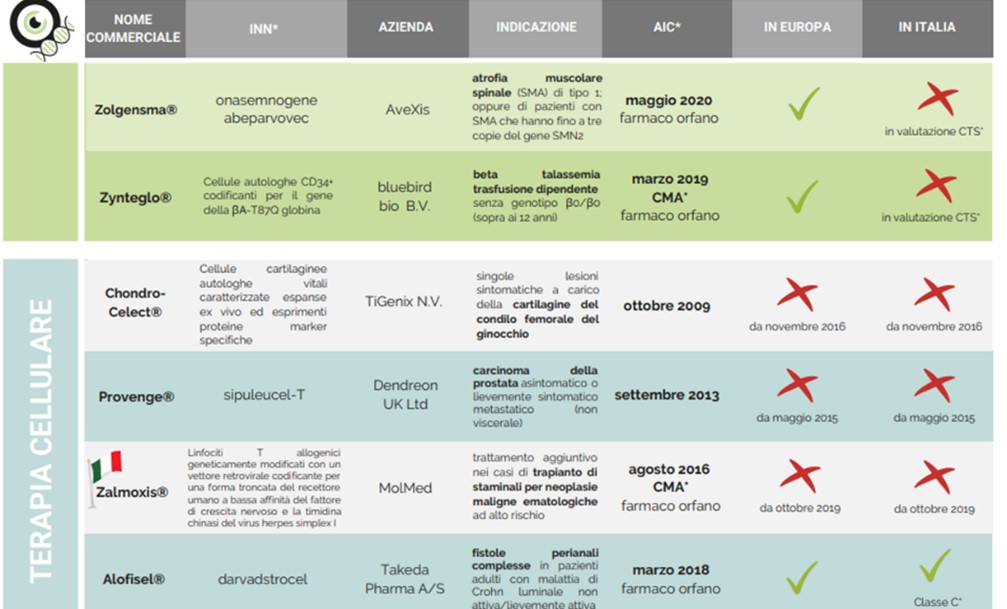
Leadership dell’Italia, avendo sviluppato ben 3 delle 9 terapie avanzate attualmente in commercio in Europa.
Osservatorio Terapie Avanzate Questo indirizzo email è protetto dagli spambots. È necessario abilitare JavaScript per vederlo.
1° generazione ATMP: prodotti di terapia cellulare e terapia genica per malattie (genetiche) ultrarare (Holoclar, Strimvelis)
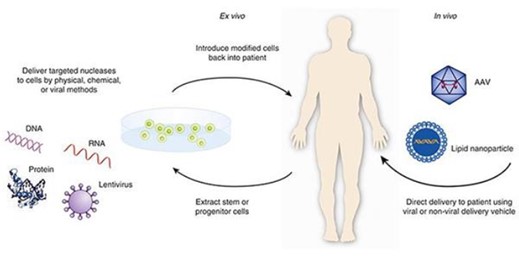
2° generazione ATMP: CAR-T per tumori del sangue, terapia genica per malattie rare (es. talassemia)
3° generazione ATMP: CAR-T per altri tumori ematologici e tumori solidi, terapia genica con bisturi molecolare (editing genomico CRISPR) anche per patologie degenerative
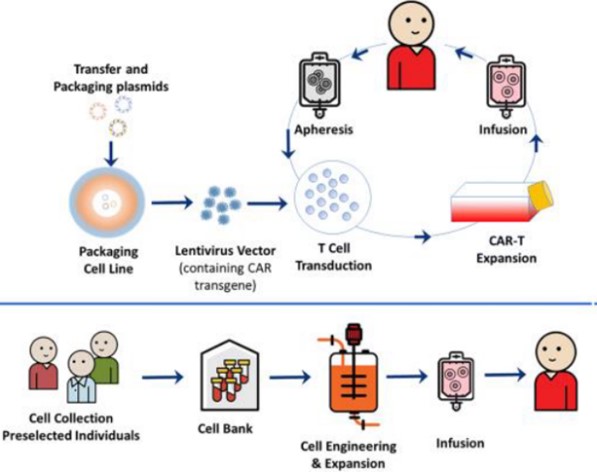
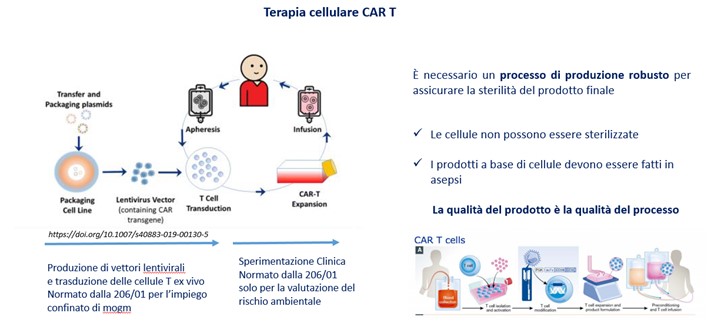
Le sperimentazioni cliniche con ATMP devono essere conformi alla legislazione che disciplina l’autorizzazione delle sperimentazioni cliniche:
- Sperimentazione clinica (Dir.2001/20/EC)
- Autorizzazione europea al commercio (EMA) (EU Reg.1394/2007) che può essere gestita tramite una procedura centralizzata dell’EMA che coinvolge tutti gli stati membri e a fronte della quale una sola autorizzazione alla commercializzazione è valida in tutta Europa
- Good Laboratory Practice, Good Manufacturing Practice, Good Clinical Practice
- Farmacovigilanza (EU Reg.1394/2007)
- Farmacopea Europea per le metodiche analitiche
Le sperimentazioni cliniche con ATMP devono essere conformi ai requisiti applicabili previsti da:
- (Dir.2009/41/EC) sull’impiego confinato di MOGM
- (Dir.2001/18/EC) sul rilascio deliberato di OGM
Lo sponsor della sperimentazione clinica che si svolgerà in Italia deve chiedere due tipi di autorizzazione per il suo medicinale sperimentale per ATMP:
- per la sperimentazione clinica (ISS/AIFA per la faseI)
- per l’impiego confinato (Min. Salute / CTS sez g)
Le due procedure sono parallele ed entrambe necessarie
Quando si applica la dir.2009/41/EC?
Procedura centralizzata Europea per l’Autorizzazione alla commercializzazione
- Procedura centralizzata europea obbligatoria: una sola autorizzazione all’immissione sul mercato valida per tutta Europa
- Procedura di 210 giorni (con clock-stop): coinvolgimento di BWP, CAT, CHMP e autorizzazione finale di EC
- Due team di valutazione indipendenti all’interno dei comitati EMA
- È stato appositamente creato il Committee for Advanced Therapies (CAT, Comitato per le Terapie Avanzate), che ha il compito di valutare la qualità, sicurezza ed efficacia delle ATMP, per poi sottoporlo all’approvazione del Committee for Medicinal Products for Human Use (CHMP, Comitato per i medicinali ad uso umano).
- L’approvazione nell’Unione Europea è centralizzata: viene emessa un’unica licenza valida in tutti i Paesi appartenenti alla UE e, con essa, un nome e un documento contenente le informazioni riguardanti il farmaco (disponibile in tutte le lingue utili).
- Successivamente ciascun Paese proseguirà con le procedure per l’autorizzazione all’immissione in commercio a livello nazionale
Le terapie avanzate rappresentano un settore biotecnologico in espansione
- Entro il 2030 potrebbero essere lanciate a livello globale fino a 60 nuove terapie cellulari e geniche.
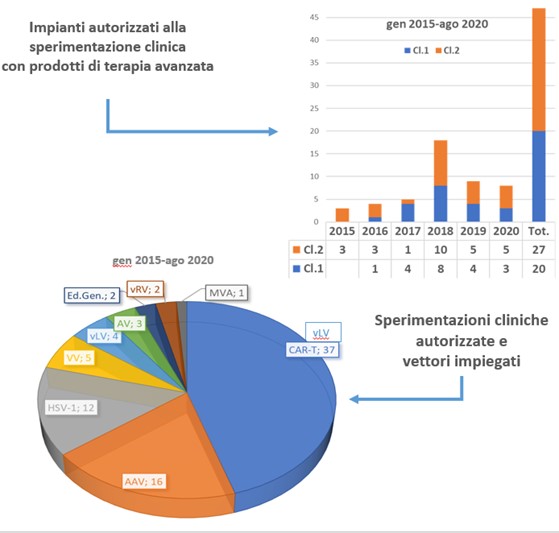
- E’ una classe di farmaci di nuova concezione e in continua evoluzione scientifica, di produzione e di requisiti regolatori.
- Le nuove conoscenze scientifiche consentiranno di passare da terapia autologa con CAR T a una terapia con cellule allogeniche derivate da un donatore sano. Utilizzare editing genico per migliorare la compatibilità con il sistema immunitario del paziente.
Link ai nuovi documenti discussi in Europa e condivisi con L’autorità Competente Italiana
La CTS sez g, ha partecipato alla redazione dei seguenti documenti EU presenti sul sito <https://ec.europa.eu/health/human-use/advanced-therapies_en>:
- Questions & Answers document
https://ec.europa.eu/health/sites/health/files/files/advtherapies/docs/gmcells_qa_en.pdf
Medicinal products for human use containing or consisting of gmos: interplay between the eu legislation on medicinal products and gmos (version 3) and submission form
- AAV -A Good practice document
https://ec.europa.eu/health/sites/health/files/files/advtherapies/docs/aavs_gp_en.pdf
Good Practice on the assessment of GMO related aspects in the context of clinical trials with AAV clinical vectors (Version 2 - December 2020)
- AAV - A common application form
https://ec.europa.eu/health/sites/health/files/files/advtherapies/docs/aavs_caf_en.pdf
Common application form for investigational medicinal products for human use that contain or consist of AAV vectors (Version 2 - December 2020)
- VIRAL VECTOR- A common application from for viral vectors
https://ec.europa.eu/health/sites/health/files/files/advtherapies/docs/vvs_caf_en.pdf
Common application form for viral vectors contained in investigational medicinal products for human use (Version 2 - December 2020)
- GM CELLS - VIRAL VECTORA Good Practice document
https://ec.europa.eu/health/sites/health/files/files/advtherapies/docs/gmcells_gp_en.pdf
Good Practice on the assessment of GMO-related aspects in the context of clinical trials with human cells genetically modified by means of viral vectors (Version 4 - December 2020)
- GM CELLS VIRAL VECTOR a common application form
https://ec.europa.eu/health/sites/health/files/files/advtherapies/docs/gmcells_caf_en.pdf
Common Application form for clinical research with human cells genetically modified by means of viral vectors (Version 4 - December 2020)
- Oncolytic virusesOncolytic viruses: Considerations for the evaluation of Shedding oncolytic_evaluation_en.pdf (europa.eu)